분자의 크기와 끓는 점의 관계를 이해하라
끓는점은 분자의 크기와 밀접한 관계가 있다
동일한 구조의 분자는 분자의 길이(=분자량)에 비례하여 녹는점과 끓는점이 증가한다. 즉 휘발성은 감소한다. 분자의 길이가 짧은 것은 이미 기체이거나 쉽게 휘발하여 자극적인 냄새인 것이 많다. 길이가 길수록 점도가 높고, 용해도가 떨어지는 것은 모든 식품 분자에 적용되는 현상이다.
몇 가지 알칸 물질의 물리적 성질과 용도
| 이름 | 분자식 | 녹는점 | 끓는점 | 밀도 | 사용/존재 |
| 메탄 | CH4 | -183 | -162 | (기체) | 천연가스(주성분), 연료 |
| 에탄 | C2H6 | -172 | -89 | (기체) | 천연가스(부성분), 화학원료 |
| 프로판 | C3H8 | -188 | -42 | (기체) | LPG(연료) |
| 부탄 | C4H10 | -138 | 0 | (기체) | LPG(연료, 라이터 연료) |
| 펜탄 | C5H12 | -130 | 36 | 0.626 | 휘발유의 성분(연료) |
| 헥산 | C6H14 | -95 | 69 | 0.659 | 휘발유의 성분, 추출 용매 |
| 헵탄 | C7H16 | -91 | 98 | 0.684 | 휘발유의 성분 |
| 옥탄 | C8H18 | -57 | 126 | 0.703 | 휘발유의 성분 |
| 데칸 | C10H22 | -30 | 174 | 0.730 | 휘발유의 성분 |
| 도데칸 | C12H26 | -10 | 216 | 0.749 | 휘발유의 성분 |
| 테트라데칸 | C14H30 | 6 | 254 | 0.763 | 디젤유의 성분 |
| 헥사데칸 | C16H34 | 18 | 280 | 0.775 | 디젤유의 성분 |
| 옥타데칸 | C18H38 | 28 | 316 | (고체) | 파라핀 왁스 성분 |
| 에코센 | C20H42 | 37 | 343 | (고체) | 파라핀 왁스 성분 |
형태의 효과 : 사이드 체인이 있으면 끓는점이 낮아진다
분자의 형태가 직선형일 때 끓는점이 높고 사이드체인이 많으면 끓는점은 낮아진다. 아래 표에서 동일한 분자량의 헥산이지만 분자의 형태가 직선인 상태는 끓는점이 69℃이고, 같은 탄소 개수(분자량)이지만 사이드 체인이 1개인 것(2-methylpentane, 3-methylpnetane)은 끓는점이 60℃, 64℃, 사이드 체인이 2개인 것(2,3-dimethylbutane, 2,2-dimethylbutane)은 58℃, 50℃로 낮다.
비슷한 분자량(80~90)의 물질의 형태와 극성에 따른 끓는점 비교
| IUPAC 명 | 분자량 | 끓는점 |
| hexane | 86 | 69 |
| 2-methylpentane | 86 | 60 |
| 3-methylpentane | 86 | 64 |
| 2,3-dimethylbutane | 86 | 58 |
| 2,2-dimethylbutane | 86 | 50 |
| ethyl ethanoate | 88 | 77 |
| methyl propanoate | 88 | 80 |
| pentanal | 86 | 103 |
| 1-aminobutane | 87 | 103 |
| 1-pentanol | 88 | 138 |
| pentanenitrile | 83 | 140 |
| butanoic acild | 88 | 164 |
| N,N-dimethylethanamide | 87 | 165 |
| butanamide | 87 | 216 |
극성의 효과 : 극성이 있으면 끓는점이 높아진다
산소를 포함한 분자는 산소가 (-)의 극성을 가진 경우가 많아 다른 분자의 (+)극성을 가진 분자와 결합하여 끓는점이 높아진다(휘발성이 낮아진다). 예를 들어 에탄, 벤젠 같은 비극성 분자보다 에틸알코올, 벤질알코올 같은 산소를 포함한 극성의 분자가 끓는점이 낮다(휘발성이 높다). 이런 효과는 분자가 적을수록 효과가 강력하고 분자가 크면 상대적으로 나머지 부위가 커지므로 효과가 적어진다. 물론 극성의 부위가 한 분자 내에 여러 개 있을수록 그 효과가 크다. 향기물질에는 주로 탄소(C)와 수소(H) 그리고 산소(O)로 되어있지만 일부 분자는 질소(N)를 가지고 있다. 질소가 있는 부위는 주로 (+)의 극성을 가지고 있고 이것 또한 산소처럼 극성효과를 부여한다.
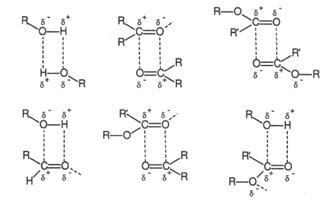
향기물질 중에는 에스테르 물질이 많다. 에스테르는 약한 극성을 가진 카복실기(-COO)를 갖고 있어 알코올과 산보다 쉽게 휘발한다. 그래서 페닐에틸메틸에테르(phenylethyl methyl ether)와 이소아밀에테르는 페닐에틸알코올에 비해 많은 탄소로 구성되나 훨씬 휘발성이 높다. 매우 큰 분자인 갈락소라이드(galaxolide)는 이런 극성 작용기를 갖고 있지 않음에도 불구하고 휘발성이 낮고 지속성이 매우 좋다. 분자량 효과가 중요하고 그 다음으로 이런 극성 효과가 중요한 것이다. 결론적으로 큰 분자는 작은 분자보다 끓는점 즉, 휘발성이 낮아 향의 강도는 낮지만 지속성이 좋다. 하지만 작용기와 형태에 따라 그 정도가 달라진다.
분자구조와 향의 특징
분자량에 따른 향의 강도는 사실 정확한 예측이 곤란하다. 분자량이 커지면 그만큼 향 분자의 개수는 감소하여 숫자상으로 불리하며 휘발성도 감소하여 불리하지만, 향의 지속성은 증가하고 향의 수용체와 결합할 부위가 존재할 가능성과 결합력은 증가하여 유리한 경향이 있다. 따라서 향을 분자의 형태나 크기만으로 어느 정도의 강도가 될 것 같은지는 정확히 예측할 수 없다.
또한 향의 강도는 향료의 용매 또는 적용하는 식품에 달려있다. 수용성 물질과 알코올은 향과 결합력이 적으므로 빨리 휘발하여 강한 첫인상을 주지만, 유지가 많은 식품에서는 이들에 결합하여 천천히 휘발하므로 향의 강도는 낮고 은은하게 느껴지는 특성을 보여준다.
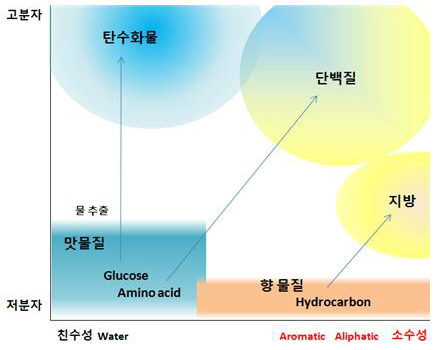
향 물질과 맛 물질의 가장 큰 차이는 물에 녹는 용해성이다
수용체에서 감지 가능한 분자는 크기가 작은 분자이다. 따라서 맛 물질도 향 물질처럼 분자량이 아주 크지는 않다. 하지만 맛 물질은 향 물질처럼 휘발성이 전혀 필요 없으므로 향기물질보다 훨씬 큰 물질도 가능하다. 맛 물질은 대체로 극성이 있어서 물에 잘 녹는다. 극성이 크고 분자량도 크므로 끓는점도 높은 것이 많다. 이런 성질을 알아야 어떤 성분은 후각으로 감지되고 어떤 성분은 미각으로 감지되는지 예측할 수 있다. 그리고 커피에서도 어떤 분자는 물에 녹고 어떤 분자는 기름에 녹을지, 그래서 어떻게 추출할지 등을 이해하는 데 중요하다. 식품의 모든 지식은 연결된 지식으로 이해해야 활용성이 높아진다.
| | 미각물질 | 후각물질 | |
| 물리적 | 끓는점 | 높다 | 낮다 |
| 비휘발성이 많다 | 반드시 휘발성 | ||
| 수용성 | 보통~잘 녹는다 | 적다~안 녹는다 | |
| 극 성 | 크다 | 작다 | |
| 화학적 | 분자량 | 저분자~고분자 | 저분자 |
| (1~2×104) | (17~300) | ||
| 관능기 | 많다 | 적다 | |
| 분자구조 | 간단~복잡 | 간단 | |
| 존재량 | 많다(%~ppm) | 적다(ppm~ppb) | |
| 감각표현 | 단순하다 | 복잡하다 | |
 | ||
| 최낙언 시아스 이사 | ||
서울대학교와 대학원에서 식품공학을 전공했으며, 1988년 12월 제과회사에 입사해 기초연구팀과 아이스크림 개발팀에서 근무했다. 2000년부터는 향료회사에서 소재 및 향료의 응용기술에 관해 연구했다. 저서로는 ‘불량지식이 내 몸을 망친다’, ‘당신이 몰랐던 식품의 비밀 33가지’, ‘Flavor, 맛이란 무엇인가?’가 있다.
☞ 네이버 뉴스스탠드에서 식품저널 foodnews를 만나세요. 구독하기 클릭

